21.42 Edit This 0 Comments »
Nama : Rizky Nasar
Kota Kelahiran : Gorontalo
Tanggal Lahir : 07 Maret 1996
Tinggi Badan : 178 cm
Agama : Islam
Nama Ayah : Nasar Mubarak Basloom Gobel (Arab-Gorontalo)
Nama Ibu : Ni Putu Ayu Baswedan (Bali)
Blasteran : Bali - Arab
Warna Favorite : Merah
Makanan : Semua Suka
Hobby : Main Bola, Apapun tentang Bola
Anak ke : 2 Dari dua Bersaudara
Twitter : @rizkynasar
TERMODINAMIKA
21.07 Posted In FISIKA Edit This 0 Comments »Termodinamika
Termodinamika adalah kajian tentang kalor (panas) yang berpindah. Dalam termodinamika kamu akan banyak membahas tentang sistem dan lingkungan. Kumpulan benda-benda yang sedang ditinjau disebut sistem, sedangkan semua yang berada di sekeliling (di luar) sistem disebut lingkungan.
Usaha Luar
Usaha luar dilakukan oleh sistem, jika kalor ditambahkan (dipanaskan) atau kalor dikurangi (didinginkan) terhadap sistem. Jika kalor diterapkan kepada gas yang menyebabkan perubahan volume gas, usaha luar akan dilakukan oleh gas tersebut. Usaha yang dilakukan oleh gas ketika volume berubah dari volume awal V1 menjadi volume akhir V2 pada tekanan p konstan dinyatakan sebagai hasil kali tekanan dengan perubahan volumenya.
W = p∆V= p(V2 – V1)
TEORI KINETIK GAS
21.05 Posted In FISIKA Edit This 0 Comments »teori kinetik gas
Di dalam teori kinetik gas terdapat suatu gas ideal. Gas ideal adalah suatu gas yang memiliki sifat-sifat sebagai berikut :
" Jumlah partikel gas banyak sekali tetapi tidak ada gaya tarik menarik (interaksi) antar partikel , Setiap partikel gas selalu bergerak dengan arah sembarang atau bergerak secara acak "
Ukuran partikel gas dapat diabaikan terhadap ukuran ruangan. Atau bisa dikatakan ukuran partikel gas ideal jauh lebih kecil daripada jarak atar partikel . Bila tumbukan yang terjadi sifatnya lenting sempurna , maka partikel gas terdistribusi merata pada seluruh ruang dengan jumlah yang banyak dan berlaku hukum Newton tentang gerak
Di dalam kenyataannya, kita tidak menemukan suatu gas yang memenuhi kriteria di atas, akan tetapi sifat itu dapat didekati oleh gas pada temperatur tinggi dan tekanan rendah atau gas pada kondisi jauh di atas titik kritis dalam diagram PT.
2. Hukum-hukum tentang gas
A.Hukum Boyle

Hasil kali tekanan(P) dan volume(V) gas pada suhu tertentu adalah tetap. Proses seperti ini disebut juga dengan isotermal (temperatur tetap).
*PV=konstan
*T2>T1
*Tidak berlaku pada uap jenuh

B.Hukum Guy Lussac

Hasil bagi volume(V) dengan temperatur (T) gas pada tekanan tertentu adalah tetap. Proses ini disebut juga isobarik (tekanan tetap).
*V/T=konstan
*P3>P2>P1
C.Hukum Charles

Hasil bagi tekanan (P) dengan temperatur (T) gas pada volume tertentu adalah tetap. Proses seperti ini disebut dengan isokhorik (volume tetap).
*P/T=konstan
*V3>V2>V1
D.Hukum Boyle-Guy Lussac
Hukum Boyle dan Guy Lussac merupakan penggabungan dari hukum Boyle dengan hukum Guy Lussac. Biasanya di dalam soal rumus yang sering digunakan adalah rumus dari hukum ini. Sekedar trik dari saya, anda bisa menamai hukum ini dengan hukum BoLu (Boyle-Lussac). Nah, dari hukum ini kita bisa mendapatkan: PV/T=konstan.
Contoh soal dan pembahasannya
1. Sebuah bejana berisi gas He yang mempunyai volume 2 L, tekanan 1 atm dan suhunya 27`C. Jika suhunya dinaikkan menjadi 127`C dan ternyata tekanannya naik 2 kalinya. Hitung volume sekarang !

2. Sebuah tangki bervolume 3000 cm3 berisi gas O2 pada suhu 20`C dan tekanan relatif pada alat 25 atm. Jika massa molar O2=32 kg/kmol, tekanan udara luar 1 atm, maka massa O2 di dalam tangki adalah …

" Jumlah partikel gas banyak sekali tetapi tidak ada gaya tarik menarik (interaksi) antar partikel , Setiap partikel gas selalu bergerak dengan arah sembarang atau bergerak secara acak "
Ukuran partikel gas dapat diabaikan terhadap ukuran ruangan. Atau bisa dikatakan ukuran partikel gas ideal jauh lebih kecil daripada jarak atar partikel . Bila tumbukan yang terjadi sifatnya lenting sempurna , maka partikel gas terdistribusi merata pada seluruh ruang dengan jumlah yang banyak dan berlaku hukum Newton tentang gerak
Di dalam kenyataannya, kita tidak menemukan suatu gas yang memenuhi kriteria di atas, akan tetapi sifat itu dapat didekati oleh gas pada temperatur tinggi dan tekanan rendah atau gas pada kondisi jauh di atas titik kritis dalam diagram PT.
2. Hukum-hukum tentang gas
A.Hukum Boyle

Hasil kali tekanan(P) dan volume(V) gas pada suhu tertentu adalah tetap. Proses seperti ini disebut juga dengan isotermal (temperatur tetap).
*PV=konstan
*T2>T1
*Tidak berlaku pada uap jenuh

B.Hukum Guy Lussac

Hasil bagi volume(V) dengan temperatur (T) gas pada tekanan tertentu adalah tetap. Proses ini disebut juga isobarik (tekanan tetap).
*V/T=konstan
*P3>P2>P1
C.Hukum Charles

Hasil bagi tekanan (P) dengan temperatur (T) gas pada volume tertentu adalah tetap. Proses seperti ini disebut dengan isokhorik (volume tetap).
*P/T=konstan
*V3>V2>V1
D.Hukum Boyle-Guy Lussac
Hukum Boyle dan Guy Lussac merupakan penggabungan dari hukum Boyle dengan hukum Guy Lussac. Biasanya di dalam soal rumus yang sering digunakan adalah rumus dari hukum ini. Sekedar trik dari saya, anda bisa menamai hukum ini dengan hukum BoLu (Boyle-Lussac). Nah, dari hukum ini kita bisa mendapatkan: PV/T=konstan.
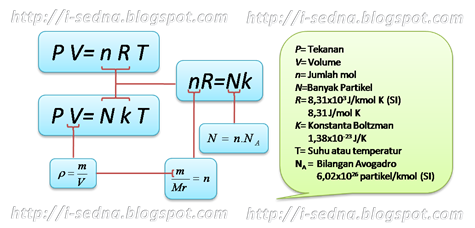
Persamaan Keadaan Gas Ideal

Contoh soal dan pembahasannya
1. Sebuah bejana berisi gas He yang mempunyai volume 2 L, tekanan 1 atm dan suhunya 27`C. Jika suhunya dinaikkan menjadi 127`C dan ternyata tekanannya naik 2 kalinya. Hitung volume sekarang !

2. Sebuah tangki bervolume 3000 cm3 berisi gas O2 pada suhu 20`C dan tekanan relatif pada alat 25 atm. Jika massa molar O2=32 kg/kmol, tekanan udara luar 1 atm, maka massa O2 di dalam tangki adalah …

FLUIDA DINAMIS
21.03 Posted In FISIKA Edit This 0 Comments »FLUIDA DINAMIS
Aliran Fluida
Ciri-ciri (karakteristik) umum dari aliran fluida
- Aliran fluida bisa berupa aliran tunak (steady) dan aliran tak tunak (non-steady). Aliran fluida dikatakan aliran tunak jika kecepatan setiap partikel di suatu titik selalu sama. Katakanlah partikel fluida mengalir melewati titik A dengan kecepatan tertentu, lalu partikel fluida tersebut mengalir dengan kecepatan tertentu di titik B. Ketika partikel fluida lainnya yang menyusul dari belakang melewati titik A, kecepatan alirannya sama dengan partikel fluida yang bergerak mendahului mereka. Hal ini terjadi apabila laju aliran fluida rendah. Contohnya adalah air yang mengalir dengan tenang. Lalu bagaimanakah dengan aliran tak-tunak ? aliran tak tunak berlawanan dengan aliran tunak. Jadi kecepatan partikel fluida di suatu titik yang sama selalu berubah. Kecepatan partikel fluida yang lebih dahulu berbeda dengan kecepatan partikel fluida yang terletak dibelakangnya.
- Aliran fluida bisa berupa aliran berolak (rotational) dan aliran tak berolak (irrotational).Bayangkan sebuah kincir mainan yang dibuang ke dalam air yang mengalir. Jika kincir itu bergerak tapi tidak berputar, maka gerakannya adalah tak berolak. Sebaliknya jika bergerak sambil berputar maka gerakannya kita sebut berolak. Contoh lain adalah pusaran air.
- Aliran fluida bisa berupa aliran termampatkan (compressible) dan aliran tak-termapatkan (incompressible). Jika fluida yang mengalir mengalami perubahan volum (atau massa jenis) ketika fluida tersebut ditekan, maka aliran fluida itu disebut aliran termapatkan. Sebaliknya apabila jika fluida yang mengalir tidak mengalami perubahan volum (atau massa jenis) ketika ditekan, maka aliran fluida tersebut dikatakan tak termampatkan. Kebanyakan zat cair yang mengalir bersifat tak-termampatkan.
- Aliran fluida bisa berupa aliran kental (viscous) dan aliran tak kental (non-viscous). Kekentalan dalam fluida itu mirip seperti gesekan pada benda padat. Makin kental fluida, gesekan antara partikel fluida makin besar.
Fluida Dinamis
Besaran-besaran fisika pada fluida dapat ditinjau saat fluida diam (hidrostatis) dan saat fluida bergerak (hidrodinamis). Hukum-hukum yang berlaku pada fluida yang bergerak berbeda dengan hukum-hukum pada fluida diam. Contohnya, selain bergantung pada massa jenis fluida dan ketinggian (kedalaman) titik pengamatan, tekanan dalam fluida juga dipengaruhi oleh kecepatan aliran fluida.
Kenyataannya, fluida sebenarnya ialah fluida sejati. Namun fluida sejati sangat rumit dan belum dipahami seluruhnya, pada pembahasan berikut akan dilakukan pendekatan untuk fluida ideal.
Fluida Ideal
Fluida ideal merupakan fluida yang tidak dapat dimampatkan atau dikatakan sebagai fluida yang tidak kompresibel, artinya volume dan massa jenisnya tidak berubah karena pengaruh tekanan.
Saat mengalir, fluida ideal tidak mengalami gesekan oleh dinding tempatnya mengalir. Demikian pula, benda yang bergerak dalam fluida ideal tidak mendapatkan hambatan dari gaya gesek. Aliran fluida ideal dikatakan sebagai aliran laminer, artinya kecepatan aliran fluida pada sembarang titik tidak berubah terhadap waktu, baik besarnya maupun arahnya. Dalam aliran laminer, setiap titik pada fluida, bergerak dengan kecepatan tetap dan tidak saling mendahului ataupun memotong yang lain.
Pada fluida yang bergerak, setiap titik memiliki kecepatan untuk tiap posisi, v(r). Oleh karena kecepatan setiap titik pada setiap posisi dapat diwakili oleh kecepatan tertentu, fluida yang bergerak dapat digambarkan sebagai medan kecepatan v(r).
Jika lintasan suatu titik pada fluida dilukiskan, akan diperoleh garis lintasan yang disebut garis aliran. Garis aliran ini terbagi menjadi dua, yaitu garis alir laminer (streamline/laminer flow) dan garis aliran turbulen (turbulent flow). Berbeda dengan garis aliran laminer yang kecepatan setiap titiknya tetap, pada garis aliran turbulen kecepatan titik dapat berubah.
Untuk fluida ideal, kecepatan setiap titik seragam. Berarti medan kecepatan v(r) dimana-mana sama. Oleh karena itu, titik-titik pada fluida ideal akan memiliki lintasan berupa aliran laminer (streamline).
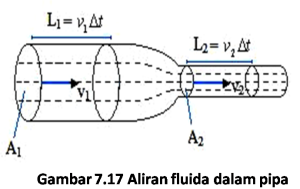
1. Persamaan Kontinuitas
Besaran yang menunjukkan volume fluida yang mengalir melalui suatu penampang setiap satuan waktu dinamakan debit aliran. Semakin rapat garis aliran, kecepatan aliran semakin besar.
Q = V / t
= A. v
A1 > A2
v2 > v1
Debit aliran disetiap titik selalu tetap, maka :
Q1 = Q2
A1V1 = A2V2 . . .persamaan kontinuitas
2. Persamaan Bernoulli
Azas Bernoulli membicarakan pengaruh kecepatan fluida terhadap tekanan di dalam fluida tersebut. Bernoulli memberikan suatu kesimpulan bahwa di dalam fluida yang mengalir dengan kecepatan lebih tinggi akan diperoleh tekanan yang lebih kecil.
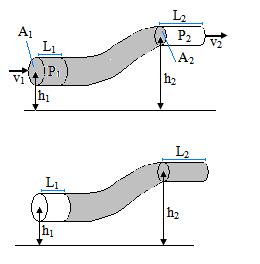
Gambar bagian fluida (garis miring lurus dan garis horizontal) bergerak melalui bagian pipa dari kedudukan yang diperlihatkan di dalam (a) ke kedudukan yang diperlihatkan di dalam (b).
Secara umum, persamaan bernoulli dituliskan sebagai berikut
V2 > V1
P2 > P1
P1 + ρgh1 + 1/2ρv12 = P2 + ρgh2 + 1/2ρv22
Dapat juga dituliskan sebagai berikut
P + ρgh + 1/2ρv2 = tetap
Pemakaian Persamaan Bernoulli dan Persamaan Kontinuitas
1. Alat pengukur venturi (venturi meter)
venturi meter adalah sebuah alat yang ditaruh di dalam sebuah pipa aliran untuk mengukur laju aliran suatu cairan.
2. Tabung pitot
alat ini digunakan untu mengukur laju aliran suatu gas.
3. Daya angkat dinamik
daya angkat dinamik adalah gaya yang beraksi pada sebuah benda, seperti sayap sebuah kapal terbang, hidrofoil, atau sebuah rotor helikopter, karena geraknya melalui suatu fluida.
4. Dorongan pada sebuah roket
REAKSI DALAM LARUTAN
21.01 Posted In KIMIA Edit This 0 Comments »
Reaksi dalam Larutan- Hampir sebagian besar reaksi-reaksi kimia berlangsung dalam larutan. Ada tiga ciri reaksi yang berlangsung dalam larutan, yaitu terbentuk endapan, gas, dan penetralan muatan listrik. Ketiga reaksi tersebut umumnya tergolong reaksi metatesisyang melibatkan ion-ion dalam larutan. Oleh karena itu, Anda perlu mengetahui lebih jauh tentang ion-ion dalam larutan.
1. Persamaan Ion dan Molekul
Selama ini, Anda menuliskan reaksi-reaksi kimia di dalam larutan dalam bentuk molekuler. Contoh, reaksi antara natrium karbonat dan kalsium hidroksida. Persamaan reaksinya:
Na2CO3(aq) + Ca(OH)2(aq) → 2NaOH(aq) + CaCO3(s)
Persamaan reaksi ini disebut persamaan molekuler sebab zat-zat yang bereaksi ditulis dalam bentuk molekul. Persamaan molekul tidak memberikan petunjuk bahwa reaksi itu melibatkan ion-ion dalam larutan, padahal Ca(OH)2 dan Na2CO3 di dalam air berupa ion-ion. Ion-ion yang terlibat dalam reaksi tersebut adalah ion Ca2+ dan ion OH– yang berasal dari Ca(OH)2, serta ion Na+ dan ion CO32– yang berasal dari Na2CO3. Persamaan reaksi dalam bentuk ion ditulis sebagai berikut.
2Na+(aq) + CO32–(aq) + Ca2+(aq) + 2OH–(aq) →2Na+(aq )+ 2OH–(aq) + CaCO3(s)
Persamaan ini dinamakan persamaan ion, yaitu suatu persamaan reaksi yang melibatkan ion-ion dalam larutan. Petunjuk pengubahan persamaan molekuler menjadi persamaan ion adalah sebagai berikut.
1. Zat-zat ionik, seperti NaCl umumnya ditulis sebagai ion-ion. Ciri zat ionik dalam persamaan reaksi menggunakan fasa (aq) .
2. Zat-zat yang tidak larut (endapan) ditulis sebagai rumus senyawa. Ciri dalam persamaan reaksi dinyatakan dengan fasa (s).
Dalam persamaan ionik, ion-ion yang muncul di kedua ruas disebut ion spektator (ion penonton), yaitu ion-ion yang tidak turut terlibat dalam reaksi kimia. Ion-ion spektator dapat dihilangkan dari persamaan ion. Contohnya, sebagai berikut.
2Na+(aq) + CO32–(aq) + Ca2+(aq) + 2OH–(aq) →2Na+(aq) + 2OH–(aq) + CaCO3(s)
Sehingga persamaan dapat ditulis menjadi:
Ca2+(aq) + CO32–(aq) →CaCO3(s)
Persamaan ini dinamakan persamaan ion bersih. Dalam hal ini, ion OH– dan ion Na+ tergolong ion-ion spektator.
Contoh Penulisan Persamaan Ion Bersih
Tuliskan persamaan ion bersih dari persamaan molekuler berikut.
Na2CO3(aq) + 2HCl(aq)⎯⎯→2NaCl(aq) + H2O(l) + CO2(g)
Jawab:
Natrium karbonat dalam air terurai membentuk ion-ion Na+ dan CO32–. HCl juga terurai dalam air menjadi ion H+ dan Cl–. Setelah terjadi reaksi, hanya NaCl yang tetap berada dalam bentuk ion-ion, yaitu Na+ dan Cl–, sedangkan yang lainnya berupa cairan murni dan gas. Karena Na+ dan Cl– tetap sebagai ion, ion-ion ini disebut ion spektator. Dengan demikian, persamaan ion bersihnya sebagai berikut.
H+(aq) + CO32–(aq) →H2O(l) + CO2(g)
a. Reaksi Pengendapan
Reaksi dalam larutan tergolong reaksi pengendapan jika salah satu produk reaksi tidak larut di dalam air. Contoh zat yang tidak larut di dalam air, yaitu CaCO3 dan BaCO3. Untuk mengetahui kelarutan suatu zat diperlukan pengetahuan empirik sebagai hasil pengukuran terhadap berbagai zat. Perhatikanlah reaksi antara kalsium klorida dan natrium fosfat berikut.
3CaCl2 + 2Na3PO4 →Ca3(PO4)2 + 6NaCl
NaCl akan larut di dalam air, sedangkan Ca3(PO4)2 tidak larut. Senyawa-senyawa fosfat sebagian besar larut dalam air, kecuali senyawa fosfat dari natrium, kalium, dan amonium. Oleh karena itu, persamaan reaksi dapat ditulis sebagai berikut.
3CaCl2(aq) + 2Na3PO4(aq) →Ca3(PO4)2(s) + 6NaCl(aq)
Dengan menghilangkan ion-ion spektator dalam persamaan reaksi itu, perasamaan ion bersih dari reaksi dapat diperoleh.
3Ca2+(aq) + 2PO43–(aq) →Ca3(PO4)2(s)
Contoh Meramalkan Reaksi Pembentukan Endapan
Tuliskan persamaan molekuler dan persamaan ion bersih dari reaksi berikut.
Al2(SO4)3 + 6NaOH →2Al(OH)3 + 3Na2SO4
Jawab:
Menurut data empirik diketahui aluminium sulfat larut, sedangkan aluminium hidroksida tidak larut. Oleh karena itu, reaksi pengendapan akan terjadi.
Al2(SO4)3(aq) + 6NaOH(aq) →2Al(OH)3(s) + 3Na2SO4(aq)
Untuk memperoleh persamaan ion bersih, tuliskan zat yang larut sebagai ion-ion dan ion-ion spektator diabaikan.
2Al3+(a ) + 3SO42–(aq) + 6Na+(aq) + 6OH–(aq)→ 2Al(OH)3(s) + 6Na+(aq) + 3SO42–(aq)
Jadi, persamaan ion bersihnya sebagai berikut.
Al3+(aq) + 3OH– (aq) → Al(OH)3(s)
b. Reaksi Pembentukan Gas
Reaksi kimia dalam larutan, selain dapat membentuk endapan juga ada yang menghasilkan gas. Misalnya, reaksi antara natrium dan asam klorida membentuk gas hidrogen. Persamaan reaksinya:
Na(s) + 2HCl(aq) →2NaCl(aq) + H2(g)
Beberapa reaksi yang menghasilkan gas disajikan pada tabel berikut.
Tabel 7.1 Beberapa Contoh Reaksi yang Menghasilkan Gas
Jenis Gas
|
Contoh Reaksi
|
| CO2 | Na2CO3(aq) + 2HCl(aq)→ 2NaCl(aq) + H2O(l) + CO2(g) |
| H2S | Na2S(aq) + 2HCl(aq)→ 2NaCl(aq) + H2S(g) |
| SO2 | Na2SO3(aq) + 2HCl(aq)→ 2NaCl(aq) + H2O(l) + SO2(g) |
Contoh Reaksi Kimia yang Menghasilkan Gas
Tuliskan persamaan molekuler dan persamaan ionik untuk reaksi seng sulfida dan asam klorida.
Jawab:
Reaksi metatesisnya sebagai berikut.
ZnS(s) + 2HCl(aq)⎯⎯→ZnCl2(aq) + H2S(g)
Dari data kelarutan diketahui bahwa ZnS tidak larut dalam air, sedangkan ZnCl2
larut. Dengan demikian, persamaan ionnya sebagai berikut.
ZnS(s) + 2H+(aq)⎯⎯→Zn2+(aq) + H2S(g)
2. Reaksi Penetralan Asam Basa
Apa yang terjadi jika asam direaksikan dengan basa? Misalkan kita mencampurkan larutan HCl 0,1 M dengan larutan NaOH 0,1 M. Di dalam air, asam kuat terurai membentuk ion H+ dan ion sisa asam. Keberadaan ion H+ dalam larutan asam ditunjukkan oleh nilai pH yang rendah (pH = –log [H+] < 7). Dalam larutan basa akan terbentuk ion OH– dan ion sisa basa. Keberadaan ion OH– dalam larutan basa ditunjukkan oleh nilai pH yang tinggi (pH = 14 – pOH > 7). Jika larutan asam dan basa dicampurkan akan terjadi reaksi penetralan ion H+ dan OH–. Bukti terjadinya reaksi penetralan ini ditunjukkan oleh nilai H mendekati 7 (pH ≈ 7). Nilai pH ≈ 7 menunjukkan tidak ada lagi ion H+ dari asam dan ion OH– dari basa selain ion H+ dan OH– hasil ionisasi air. Dengan demikian, pada dasarnya reaksi asam basa adalah reaksi penetralan ion H+ dan OH–. Persamaan reaksi molekulernya:
HCl(aq) + NaOH(aq ) →NaCl(aq) + H2O(l)
Persamaan reaksi ionnya:
H+(aq)+ Cl–(aq)+ Na+(aq)+OH–(aq) →Na+(aq)+ Cl(aq)+ H2O(l)
Persamaan ion bersihnya:
H+(aq) + OH–(aq) →H2O(l)
Reaksi asam basa disebut juga reaksi penggaraman sebab dalam reaksi asam basa selalu dihasilkan garam. Pada reaksi HCl dan NaOH dihasilkan garam dapur (NaCl). Beberapa contoh reaksi penetralan asam basa atau reaksi pembentukan garam sebagai berikut.
a. H2SO4(aq) + Mg(OH)2(aq) →MgSO4(aq) + 2H2O(l)
b. HNO3(aq) + Ca(OH)2(aq) →Ca(NO3)2(aq) + H2O(l)
c. HCl(aq) + NH4OH(aq) →NH4Cl(aq) + H2O(l)
3. Perhitungan Kuantitatif Reaksi dalam Larutan
Perhitungan kuantitatif reaksi-reaksi kimia dalam larutan umumnya melibatkan konsentrasi molar dan pH. Hal-hal yang perlu diketahui dalam mempelajari stoikiometri larutan adalah apa yang diketahui dan yang ditanyakan, kemudian diselesaikan dengan empat langkah berikut.
1. Tuliskan persamaan reaksi setara.
2. Ubah besaran yang diketahui ke satuan mol.
3. Gunakan perbandingan koefisien dari persamaan kimia setara untuk menentukan besaran yang tidak diketahui dalam mol.
4. Ubah satuan mol ke dalam besaran yang ditanyakan.
4. Perhitungan pH Campuran
Jika larutan asam atau basa dicampurkan dengan larutan asam atau basa yang sejenis atau berbeda jenis maka konsentrasi asam atau basa dalam larutan itu akan berubah. Perubahan konsentrasi ini tentu akan mengubah pH larutan hasil pencampuran.
Contoh Menghitung pH Campuran Asam yang Sama
Sebanyak 50 mL larutan HCl 0,1 M dicampurkan dengan 100 mL larutan HCl 0,5 M.
Berapakah pH larutan sebelum dan sesudah dicampurkan?
Jawab:
pH 50 mL larutan HCl 0,1 M = –log [H+] = 1,0
pH 100 mL larutan HCl 0,5 M = –log (0,5) = 0,3
Setelah dicampurkan, volume campuran menjadi 150 mL. Jumlah mol HCl dalam campuran sebagai berikut.
50 mL × 0,1 mmol mL–1 HCl = 5 mmol
100mL × 0,5 mmol mL–1 HCl = 50 mmol
Konsentrasi molar HCl dalam campuran = 55mmol/ 150mL = 0,367 M
Jadi, pH campuran = –log [0,367] = 0,44
Pencampuran larutan asam dan basa akan membentuk reaksi penetralan. Jika jumlah mol asam dan basa dalam campuran itu sama,terjadilah penetralan sempurna sehingga pH larutan sama dengan 7. Tetapi, jika terdapat salah satu pereaksi berlebih, kelebihannya akan menentukan pH larutan hasil pencampuran.
Contoh Menghitung pH Campuran Asam dan Basa
Jika 25 mL HCl 0,5 M dicampurkan dengan 50 mL NaOH 0,1M, bagaimanakah pH hasil pencampuran?
Jawab:
Untuk mengetahui nilai pH campuran asam basa, perlu ditentukan jumlah mol asam atau basa yang berlebih setelah terjadi reaksi penetralan.
H+(aq) + OH–(aq) →H2O(l)
Jumlah mol ion H+ dalam HCl = 25 mL × 0,5 mmol mL–1 = 12,5 mmol
Jumlah mol ion OH– dalam NaOH = 50 mL × 0,1 mmol mL–1 = 5 mmol
Seluruh ion OH– dinetralkan oleh ion H+ sehingga sisa ion H+ dalam larutan sebanyak 7,5 mmol. Karena volume campuran 75 mL maka konsentrasi molar ion H+ sisa:
[H+] = 7,5mmol/ 75mL = 0,1 M
Dengan demikian, pH campuran = –log (0,1) = 1.